|
|
BTS TP 95
I : 1) Flux lumineux émis par la lampe : F = k.P
F = 37.103 lm
|
|
2)
cos a = Ia/I0.
Ia = I0.cos a
3) I = dF/dW
dF = I.dW = I0.cos a.2p.sin a.da = 2pI0.sin a.d(sin a)
On intègre pour a = 0 à p/2
![]()
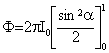
F = pI0
I0 = F/p
I0 = 12.103 Cd
4) E = dF/dS' dS' est l'élément de surface du sol.
Comme a = 0 :
E = I0.dW/dS'
Comme le point est à la verticale de la lampe :
dW/dS' = 1/h2
E = I0/h2
E = 186 lux
II :
1-a) Système étudié : le gaz dans R1 et dans le corps de pompe. Première aspiration :
État initial : P0, V1, T1 État final : P1, V’1 = V1 + V, T1
P0V1 = P1(V1 + V)
![]()
1-b) Deuxième aspiration :
![]()
Troisième aspiration :
![]()
nième aspiration :
![]()
1-c) Si on remplace dans l’expression de P2, P1 par sa valeur :

Si on fait ça pour toutes les pressions, on obtient :

1-d) V1/(V1 + V) est plus petit que 1. Quand on élève cette expression à la puissance n, n étant très grand, elle tend vers 0, donc Pn aussi.
2) Système étudié : tout le gaz, contenu dans R1, R2 et dans le corps de pompe qui est vide au départ et à l’arrivée.
Etat initial : P0, V1 + V2, T1 Etat final : Pf, V2, T1
P0(V1 + V2) = Pf.V2
![]()
Pf = 105(102/2)
Pf = 51.105 Pa
III : 1) Oxydant : MnO4- réducteur : SO2
2) L'ion Mn2+ étant incolore, tant qu'il y a du SO2, la solution reste incolore. Quand il n'y en a plus, la coloration violette persiste à cause de l'ion MnO4-.
3) n(SO2) = (5/2).n(MnO4-)
4) n(MnO4-) = C.V
n(MnO4-) = 5.10-3.12,5.10-3
n(MnO4-) = 6,25.10-5 mol
5) Dans 10 ml de solution :
n(SO2) = 1,56.10-4 mol
6) Dans 500 ml de solution :
n'(SO2) = 7,81.10-3 mol
7) La masse de soufre dans 500 ml de solution, donc dans 100 g de gazole :
m = M.n'(SO2)
m = 0,250 g
Teneur massique : 0,25 % ce qui est conforme à la législation.
Pollution par le gaz SO2 qui est dangereux à respirer.