thermodynamique
I
: P1V1
= m1rT1
P2V2 = m2rT2
T2
= 91 °C
II : T = PV/nR
T = 361 K
III : a) 1 atm = 105 Pa et n = PV/RT = 128,5 mol
M
= n.M
m
= 4,11 kg
v
= 22,4;128,5
v
= 2811 L
b) P2 = P1.T2/T1
P2
= 142 atm
IV : 1) n = 0,67 mol
2) P2 = 2,08.105 Pa
3) P0V2 = n1RT2
et après avoir ramener la température à la valeur T3 = 0 °C : P3V2 = n1RT3
P3 = 0,732.105 Pa
V : 1) v2 = 15,8 m.s-1
2) v2' = 8,37 m.s-1
3) Si le liquide descendait jusqu'au trou la pression intérieure serait égale à 0,75.105 Pa et on trouve alors une vitesse négative ce qui est impossible.
Quand le liquide ne coule plus, on est en hydrostatique et il faut calculer la pression du gaz :
P
= 1,5.P0/(4 – h')
Patm
= 1,5.P0/(4 – h') + h'rg
h'
= 0,8 m
VI : Loi des GP nous donne : 10.P1/P2 = T1/T2
Loi pour les adiabatiques : P1/P2 = (1/10)g
T2 = 986 K
W = 8575 J
VII :
1) V1
= 0,1 l
DU
= 0 = W + Q
W = - Q
= 230 J
2) V2
= 0,518 l
T2
= 155,38 K
DT
= 145 K
W = -
120 J
VIII
: 1)
V1 = 0,25 m3
V2 = 0,052 m3
T2
= 562 K
V3
= 0,0924 m3
V4
= 0,202 m3
T4
= 730 K
V5 = 0,277 m3
V6 = 0,607 m3
T6 = 730 K
2) W = -
36 kJ
Qp
= 127 kJ
Q34 = 0 kJ et W34 = - 56 kJ
W45 = - 22 kJ et Q45 = 79 kJ
W56 = - 56 kJ et Q56 = 0 kJ
W61 = 36 kJ et Q61 = - 125 kJ
IX TP 02: 1) PV = nRT d'où
![]()
Comme m = n.M, on obtient :
![]()
AN : P = 10 bars = 10.105 Pa ; V = 500 L = 0,5 m3 ; R = 8,31 SI ; T = 10 °C = 283 K et
M = 3.18 + 8.1 = 44 g
m = 106.0,5.44/8,31.283 = 9354,8 g
m = 9,35 kg
2) Comme n, R, V sont constants, on a P/T qui est constant, donc :
P/T = P'/T'
![]()
AN : P = 10 bar (P' sera donc en bars) ; T = 283 K ; T' = 265 K
P'
= 10.265/283 = 9,364 bars
P'
= 9,36 bars
3) C3H8
+ 5 O2 ®
4 H2O + 3 CO2
4) Qlib = n'.Q
n' est le nombre de moles consommé. Il est égal au nombre de moles initial n, quand P = 10 bars, moins le nombre de mole final nf, quand Pf = 8 bars.
Comme V, T et R sont constants, on a :
nf/Pf
= n/P
nf
= n.Pf/P
donc :
n' = n – nf = n – n.Pf/P
![]()
AN : n = m/M = 9354,8/44 = 212,6 mol
n' = 212,6( 1 – 8/10)
n' = 42,5 mol
Qlib = 42,5.2220
Qlib = 9,44.104 kJ
5) Si la
pression finale est 5 bars, la moitié de la pression de départ, le nombre de
moles restant est la moitié :
n1 = 212,6/2 = 106,3 mol
Qlib = n1.Q
Et comme la puissance P du brûleur est égale à Qlib/t, on a :
P = n1.Q/t
![]()
AN : t =
106,3.2220/3 = 78662 s
t
= 21,9 h
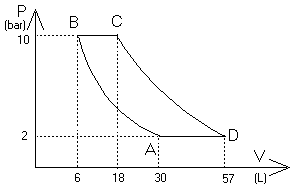
X TP 02 : 1) : PV = nRT d'où n = PV/RT
État initial A : PA = 2 bar = 2.105 Pa ; VA = 30 L = 30.10-3 m3 ; T = 16 °C = 289 K
n = 2.105*30.10-3/8,31*289 = 2,4983
n = 2,5 mol
2) De l'état A vers l'état B : compression isotherme donc TB = TA ; PB = ? ; VB = 6.10-3 m3
PBVB = PAVA
![]()
AN : PB
= 2.105*30.10-3/6.10-3
PB
= 106Pa
b) De B vers C : échauffement isobare donc PC = PB ; VC = 18.10-3 m3 ; TC = ?
VC/TC = VB/TB
![]()
TC = 18*289/6 = 867 K
TC = 594 °C
c) De C vers D : trois inconnues, PD, VD et TD. L'équation des gaz parfait (PV = nRT) et la relation spéciale pour une détente adiabatique (PVg = cst) permettent d'en trouver deux mais pas trois. Pour trouver la troisième, on va utiliser le fait que l'on revient à A par un refroidissement isobare.
d) De D ver A :refroidissement isobare donc PD = PA :
PD = 2.105 Pa
c) PDVDg = PCVCg
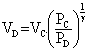
VD = 18.51/1,4
VD = 56,8 L
Si on considère le refroidissement isobare de D vers A, l'équation des gaz parfaits nous donne :
VD/TD = VA/TA
![]()
TD = 289*56,8/30 = 547 K
TD = 274 °C
|
|
Pression (Pa) |
Volume (m3) |
Température (K) |
|
Etat A |
2.105 |
3.10-2 |
289 |
|
Etat B |
106 |
6.10-3 |
289 |
|
Etat C |
106 |
1,8.10-2 |
867 |
|
Etat D |
2.105 |
5,68.10-2 |
547 |
3)
4) Échauffement isobare donc :
WBC = - P(VC – VB)
AN : WBC = - 106*12.10-3
WBC = - 1,2.104 J = - 12 kJ
QBC = n.Cp(TC – TB)
QBC
= 2,5*29,1*(594 – 16)
QBC
= 42 kJ
XI :
a) P1 = 80 cm
P2 = 800 cm
V1 = 10 l
V2 = ?
T1 = 293 K
T2 = T1 = 293 K car
transformation isotherme
Loi pour une transformation isotherme : P1V1 = P2V2
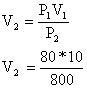
V2 = 1 l
![]()
W1
= (80.105/76).10-2Ln10
W1
= 2420 J
Pour une transformation isotherme,
on a Q = - W
Q1 = - 2420 J
b)
P2 = 800 cm
P3 = 80 cm
V2 = 1 l
V3 = ?
T2 = T1 = 293 K
T3 = ?
On a deux inconnues, il faut donc deux équations. L’une est tiré de la loi des gaz parfait :
![]()
L’autre est la loi pour une transformation adiabatique :
On tire de la première :
![]()
et de la seconde :
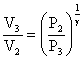
d’où :
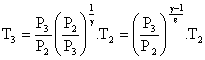
T3 = (0,1)0,3/1,3.293
= 293.0,10,23
T3 = 172,5 K
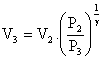
V3 = 1.(10)1/1,3 = 1.100,769
V3 = 5,878 l
![]()
W2
= - 1450 J
Q2
= 0
c)
W3 = - P3(V3 – V1)
W = - (80.105/76)(5,878 – 10)10-3 = -1,0526.105(-4,122)10-3
W3 = 434 J
Comme on a un cycle, on a :
SW + SQ = 0
- 1450 + 434 + Q3 = 0
Q3 = 1016 J
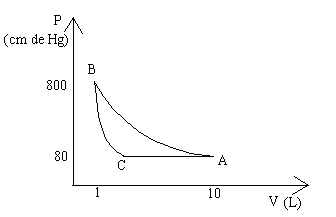 |
XII TP 93: 1) La somme algébrique du travail W et de la chaleur Q échangés par le système avec le milieu extérieur est égale à la variation DU de son énergie interne.
2) L'enthalpie H est une fonction d'état, définie dans les conditions d'équilibre de pression, qui est égale à la somme de l'énergie interne U avec le produit de la pression par le volume pv.
H = U + pv
3) Pour une transformation à pression constante, le travail échangé par le système avec l'extérieur est :
DW = - p.DV
La variation d'enthalpie vaut :
DH
= DU
+ p.DV
car Dp = 0 puisque la pression est constante.
On a donc :
DH
= DU
– DW
Comme DU
= DW
+ Qp
DH = Qp
4) La chaleur latente de changement d'état d'un corps pur est la chaleur qu'il faut fournir à l'unité de masse de ce corps pour le faire changer d'état. Elle est égale à la variation d'enthalpie.
5-a) Il y a échauffement :
Q1 = m.cs.DT
Avec m = m.V = 2699.0,5.10-6.0,2.10-6 = 269,9.10-12 kg
Q1= 269,9.10-12.900.(933 – 293)
Q1 = 1,55.10-4 J
5-b) Après échauffement du solide, on a changement d’état :
Q2 = Q1 + m.Lf
Q2 = 1,5546.10-4 + 269,9.10-12.397.103
Q2 = 2,63.10-4 J
5-c) Après obtention du liquide, on a échauffement du liquide jusqu’à 2740 K puis changement d’état (passage du liquide à la vapeur) :
Q3
= Q2 + m.cl.(Tv – Tf) + m.Lv
Q3 = 2,63.10-4 + 269,9.10-12.1090.(2740 – 933) + 269,9.10-12. 10500.103
Q3 = 2,63.10-4 + 5,32.10-4 + 28,34.10-4
Q3 = 3,63.10-3 J
6) Q3 = P.t
P = Q3/t
P = 3,63.10-3/10-3
P = 3,63 W
XIII TP 95 : 1-a) Système étudié : le gaz dans R1 et dans le corps de pompe .Première aspiration :
Etat initial : P0, V1, T1 Etat final : P1, V’1 = V1 + V, T1
P0V1 = P1(V1 + V)
![]()
1-b) Deuxième aspiration :
![]()
Troisième aspiration :
![]()
nième aspiration :
![]()
1-c) Si on remplace dans l’expression de P2, P1 par sa valeur :
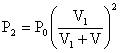
Si on fait ça pour toutes les pressions, on obtient :
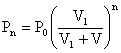
1-d) V1/(V1 + V) est plus petit que 1. Quand on élève cette expression à la puissance n, n étant très grand, elle tend vers 0, donc Pn aussi.
2) Système étudié : tout le gaz, contenu dans R1, R2 et dans le corps de pompe qui est vide au départ et à l’arrivée.
Etat initial : P0, V1 + V2, T1 Etat final : Pf, V2, T1
P0(V1 + V2) = Pf.V2
![]()
Pf = 105(102/2)
Pf = 51.105 Pa
Retour aux exercices.